Definição:
A capacidade de perder ou absorver calor que um determinado corpo tem, em razão da variação de temperatura sofrida por ele, é definida como Capacidade Térmica ou Capacidade Calorífera.
A capacidade de perder ou absorver calor que um determinado corpo tem, em razão da variação de temperatura sofrida por ele, é definida como Capacidade Térmica ou Capacidade Calorífera.
A unidade do SI é J/K (Joule por Kelvin), porém sua unidade usual é cal/ºC.
*Ela caracteriza o corpo, e não a substância que o constitui.
*A capacidade térmica de 1g de água é de 1cal/ºC já que seu calor específico é 1cal/g.ºC .
*Ela caracteriza o corpo, e não a substância que o constitui.
*A capacidade térmica de 1g de água é de 1cal/ºC já que seu calor específico é 1cal/g.ºC .
Um exemplo de capacidade térmica dos corpos é o da piscina e o do ar. Durante o dia o ar e a piscina recebem a mesma quantidade de calor, porém o ar se esquenta mais rápido que a piscina, e também é mais rápido para esfriar. Isso ocorre porque o ar e a água possuem capacidades térmicas diferentes.
A capacidade térmica é característica de um corpo, não do material que o constitui. Por isso, se quisermos aquecer dois corpos que são constituídos do mesmo material, mas de massas diferentes, será necessário fornecer mais calor ao corpo de maior massa.
Exercícios:
Exercícios:
1. (PUCCAMP) Uma barra de cobre de massa 200g é retirada do interior de um forno, onde estava em equilíbrio térmico, e colocada dentro de um recipiente de capacidade térmica 46cal/°C que contém 200g de água a 20°C. A temperatura final de equilíbrio é de 25°C. A temperatura do forno, em °C, é aproximadamente igual a: Dado: CCu = 0,03 cal/g°C
a) 140
b) 180
c) 230
d) 280
e) 300
Resposta: C
2. Um recipiente de capacidade térmica 50 cal/ºC contém 200g de água a 40ºC. Introduz no recipiente 50g de gelo a 0ºC. Admitindo q não há trocas de calor com o ambiente, a temperatura final de equilíbrio, em ºC, é:
Dados:
calor especifico da água = 1cal/gºC
calor latente de fusão de gelo = 80 cal/g
Dados:
calor especifico da água = 1cal/gºC
calor latente de fusão de gelo = 80 cal/g
É um teste bastante simples, envolvendo troca de calor entre corpos.
Quem receberá calor será o GELO, que precisa para derreter totalmente:
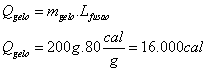
Quem fornecerá calor será o conjunto RECIPIENTE + ÁGUA.
Calculando a quantidade de energia MAXIMA que poderá ser fornecida antes de atingir a temperatura mais baixa possível 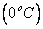 :
:
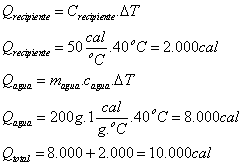
Como a energia MÁXIMA que o sistema pode perder ao gelo é de 10.000 cal e são necessárias 16.000 cal para fundir totalmente o gelo, conclui-se que o equilíbrio térmico  ocorrerá sem que todo gelo derreta.
ocorrerá sem que todo gelo derreta.

cadê o cálculo da 1?
ResponderExcluirNo início da segunda questão calculou-se a quantidade de calor que o gelo necessitou para derreter, neste caso não entendi como a massa de gelo deu 200g, no enunciado fala que é 50g, me expliquem por favor.
ResponderExcluir